Estrutura de Lewis

Estruturas de Lewis (também conhecidos como estruturas de ponto de Lewis ou de elétrons, diagramas de ponto de Lewis ou de elétrons e fórmulas de ponto de Lewis) são diagramas que mostram a ligação entre os átomos de uma molécula e os pares de elétrons livres que podem existir na molécula. A estrutura de Lewis pode ser desenhada para qualquer molécula ligada de forma covalente, bem como coordenação de compostos. A estrutura de Lewis, hora dada após a publicação do artigo "O Átomo e a molécula" pelo químico-físico americano Gilbert N. Lewis, no ano de 1916. São similares aos diagramas de elétrons em que os elétrons de valências em pares livres são representados como pontos, mas contém linhas para representar pares compartilhados numa ligação química (Ligação simples, dupla, tripla, etc).[1][2] Estruturas de Lewis mostram cada átomo e a sua posição na estrutura da molécula utilizando o seu símbolo químico. As linhas são desenhadas entre os átomos que estão ligados uns aos outros (os pares de pontos pode ser usado em vez de linhas). Excesso de elétrons que formam pares livres são representados como pares de pontos, e são colocadas ao lado dos átomos.[3]
Embora grupo principal de elementos do segundo período costumam reagir, ganhando , perdendo (Oxirredução) ou compartilhando elétrons até que eles conseguiram uma configuração eletrônica mais estável, com a camada de valência com (8) elétrons, conforme a regra do octeto, outros elementos obedecem a regras diferentes. De hidrogênio () só podem formar ligações que partilham apenas dois elétrons, enquanto que os metais de transição estão em conformidade a uma exceção a regra do octeto (12 elétrons) (por exemplo, os compostos tais como o íons de permanganato). Geralmente, os elementos abaixo do segundo período são capazes de expandir suas camadas de valência para acomodar mais de 8 elétrons.
Representação dos átomos
[editar | editar código-fonte]Aos diferentes átomos põe-se-lhes um ponto (ou uma cruz) ao redor de seu símbolo pela cada elétron da camada de valência. Como a quantidade máxima de elétrons possível são oito, se colocam por casais: uma na parte superior, outra na inferior, um par à esquerda e outro à direita. Primeiro deve-se pôr um na cada posição, e depois se completam os casais, exceção do hélio; seus dois elétrons aparecem juntos.[4]
Moléculas
[editar | editar código-fonte]As moléculas mais simples têm um átomo central que fica rodeado pelo resto de átomos da molécula. Nas moléculas formadas por vários átomos de um elemento e um só de outro elemento diferente, este último é o átomo central. Nos compostos criados por átomos diferentes de diferentes elementos, o menos eletronegativo é o átomo central, exceção Oxigenio. Geralmente, nestas moléculas singelas primeiro há que unir a cada átomo não central com o central mediante uma ligação química simples.[5]
Em alguns casos é difícil determinar o átomo central, em general quando todos os átomos dos elementos do composto aparecem mais de uma vez na molécula. Nestas ocasiões, a determinação de quais átomos se encontram unidos a quais átomos se deve realizar de algum outro modo, já seja por prova e erro ou mediante o conhecimento prévio de estruturas que possam resultar similares.[6]
Elétrons
[editar | editar código-fonte]Quando a estrutura de Lewis é molecular há que utilizar formulas adequadas. O número total de elétrons representados em um diagrama de Lewis tanto faz à soma dos elétrons de valência da cada átomo. Os elétrons que não se encontram na camada de valência de um determinado átomo não se representam.
Quando os elétrons de valência têm sido determinados, devem localizar na estrutura. Eles devem ser localizados inicialmente como pares livres: um par de pontos pela cada par de elétrons disponível. Os pares livres devem-se pôr inicialmente nos átomos externos (com exceção do hidrógeno) até que a cada átomo externo tem oito elétrons em pares de vinculação e pares livres; os pares livres extra devem ser localizados no átomo central. Quando há dúvidas, os pares livres devem ser localizados no átomo ou átomos mais eletronegativo primeiro.
Uma vez que todos os pares livres têm sido localizados, os átomos, especialmente os centrais, podem não ter um octeto de elétrons. Nesse caso, os átomos devem formar uma ligação dupla; um par livre de elétrons é movido para formar uma segunda ligação entre os dois átomos. Bem como o par de ligação compartilhada entre os dois átomos, o átomo que originalmente tinha o par livre segue tendo um octeto; e o outro átomo agora tem dois elétrons mais em sua última camada.
Fora dos compostos orgânicos, só uma minoria dos compostos tem um octeto de elétrons em sua última camada. Octetos incompletos são comuns para os compostos dos grupos 2 e 13 tais como o berílio, boro, e alumínio. Compostos com mais de oito elétrons na representação da estrutura de Lewis da última camada do átomo, são chamados hiper valentes, e são comuns nos elementos dos grupos 15 ao 18, tais como o fósforo, azufre, iodo e xenón.
As estruturas de Lewis para íons poliatômicos devem ser desenhadas mediante o mesmo método. Quando se contam os elétrons, os íons negativos devem ter elétrons extra localizados em suas estruturas de Lewis; os íons positivos devem ter menos elétrons que uma molécula neutra.
Quando se escreve a estrutura de Lewis de um íon, a estrutura inteira é localizada entre colchetes, e o ônus se escreve como um exponente no rincão direito superior, fora dos colchetes.
Um método mais simples tem sido proposto para construir estruturas de Lewis eliminando a necessidade de contar os elétrons: os átomos são desenhados mostrando os elétrons de valência, as ligações formam, então, os pares de elétrons de valência dos átomos envolvido-os no processo de criar as ligações, ânions e cátions são formados acrescentando ou removendo elétrons dos átomos apropriados.
A regra do octeto
[editar | editar código-fonte]Segundo a regra do octeto, os átomos são mais estáveis quando conseguem oito elétrons na camada de valência, sejam pares solitários ou compartilhados mediante a ligação covalente. Considerando que a cada ligação covalente simples contribui dois elétrons à cada átomo da união, ao desenhar um diagrama ou estrutura de Lewis, há que evitar atribuir mais de oito elétrons à cada átomo.
No entanto, há algumas exceções. Por exemplo, o hidrógeno tem um só orbital em sua camada de valência, a qual pode aceitar como máximo dois elétrons; por isso, só pode compartilhar seu orbital com só um átomo formando um só ligação química. Por outra parte, os átomos não metálicos a partir do terceiro período podem formar "octetos expandidos" isto é, podem conter mais que oito orbitais em sua camada de valência, pelo geral colocando os orbitais extra em sub níveis.
Regra dos 18 elétrons e dos 32 elétrons
[editar | editar código-fonte]A regra dos 18 elétrons aplica-se para átomos a partir do quarto período da tabela periódica, os quais podem completar 18 elétrons para encher seus orbitais e conseguir uma configuração de elemento químico conhecida como superextragasnoble. De forma similar, a partir do sexto período os átomos podem completar 32 elétrons para encher seus orbitais.[7]
Ônus Formal
[editar | editar código-fonte]
Em termos de estruturas de Lewis, carga formal utiliza possíveis estruturas topológicas e de ressonância para descrever, comparar e avaliar determinada carga eletrônica aparente de cada átomo dentro, com base na sua estrutura de pontos de elétrons, assumindo ligações covalentes exclusivas ou ligações não polares. Usada na determinação de possíveis re-configurações eletrônicas quando se refere ao mecanismos de reação, e muitas vezes resulta no mesmo sinal que a carga parcial do átomo, com exceções. Em geral, a carga formal de um átomo pode ser calculada através da seguinte fórmula, assumindo definições não padronizadas:
- , onde:
- é o ónus formal.
- representa o número de elétrons de valência em um átomo livre do elemento.
- representa o número de elétrons não compartilhados do átomo.
- representa o número total de ligações químicas que o átomo tem com outro átomo.
O ônus formal do átomo é calculado como a diferença entre o número de elétrons de valência que um átomo neutro poderia ter e o número de elétrons que pertencem a ele na estrutura de Lewis. Os elétrons nas ligações covalentes são divididos equitativamente entre os átomos envolvidos na ligação. O total do ônus formal em um íon que deve ser igual ao ônus do íon, e o total do ônus formal de uma molécula neutra deve ser igual a zero.
Ressonância
[editar | editar código-fonte]Para algumas moléculas e íons, é difícil determinar quais pares livres deve ser movido para formar ligações duplas ou triplas. Este é, por vezes, o caso quando vários átomos do mesmo tipo rodeiam o átomo central, e é especialmente comum para os íons poliatômicos.
Quando esta situação ocorre, a estrutura de Lewis da molécula é dita ser uma estrutura de ressonância, e a molécula existe como um híbrido de ressonância. Cada uma das diferentes possibilidades é sobreposta sobre os outros, e a molécula é considerada como tendo uma estrutura de Lewis equivalente a uma média desses estados.
O íon de nitrato (), por exemplo, tem de formar uma ligação dupla entre o azoto e um de oxigénio de satisfazer a regra do octeto de azoto. Contudo, porque a molécula é simétrica, não importa qual dos formulários do oxigénio da ligação dupla. Neste caso, existem três possíveis estruturas de ressonância. Expressando ressonância quando desenho estruturas de Lewis pode ser feito tanto pelo desenho cada uma das possíveis formas de ressonância e colocando setas de duas pontas entre eles ou usando linhas tracejadas para representar as ligações parciais (embora este último é uma boa representação do híbrido de ressonância que é não, formalmente falandas, uma estrutura de Lewis).
Ao comparar as estruturas de ressonantes para a mesma molécula, geralmente aqueles com o menor número de acusações formais contribuir mais para a ressonância híbrida global. Quando mudanças formais são necessárias, estruturas ressonantes que têm cargas negativas sobre os elementos mais eletronegativos e cargas positivas sobre os elementos menos eletronegativos são favorecidas.
Ligações simples, também podem ser movidas da mesma maneira para criar estruturas ressonantes a moléculas hipervalentes tais como hexafluoreto de enxofre, que é a descrição correta de acordo com os cálculos de química quântica, em vez do modelo de octeto expandido comum.
Exemplo: Estrutura de Lewis para o íon de nitrito
[editar | editar código-fonte]
- Escolha o átomo central, o azoto ou nitrogênio é o átomo de menos eletronegativo dos dois, de modo que é o átomo central por vários critérios.
- Contar os elétrons de valência, o nitrogênio tem cinco elétrons de valência; cada oxigênio tem , para um total de O íon tem uma carga de , o que indica um elétron extra, de modo que o número total de elétrons é .
- Coloque pares livres, cada oxigénio deve ser ligado ao nitrogênio, tal qual duas ligações usam os quatro elétrons, dois elétrons para cada ligação. Os 14 elétrons restantes devem ser inicialmente colocado como 7 pares livres. Cada oxigênio pode ter um máximo de três pares livres, dando a cada oxigênio 8 elétrons, incluindo o par ligação. O sétimo par livre deve ser colocado sobre o átomo de azoto.
- Satisfazer a regra do octeto, os dois átomos de oxigênio atualmente com 8 elétrons atribuídos entre eles. O átomo de nitrogênio tem apenas 6 elétrons atribuídos a ele. Um dos pares livres em um átomo de oxigénio deve formar uma ligação dupla, mas para qualquer átomo funcionará igualmente bem. Portanto, existe uma estrutura de ressonância.
- Desenhar a estrutura, as duas estruturas de Lewis devem ser desenhada: Cada estrutura possui um dos dois átomos de oxigénio com dupla ligação ao átomo de azoto. O segundo átomo de oxigénio em cada estrutura será único ligado ao átomo de azoto. Coloque entre parênteses cada estrutura, e adicione a carga (-) no canto superior direito fora dos parênteses. Desenhe uma seta dupla entre as duas formas de ressonância.
-
Íon ressonante de Nitreto.
-
Coloque entre parênteses cada estrutura, e adicione a carga (-) no canto superior direito fora dos parênteses.
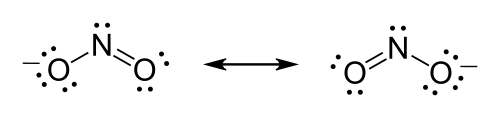
Diagrama de Ponto de Lewis
[editar | editar código-fonte]| Grupo # | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Período | ||||||||||||||||||||
| 1 |
|
| ||||||||||||||||||
| 2 |
|
|
|
|
|
|
|
| ||||||||||||
| 3 |
|
|
|
|
|
|
|
| ||||||||||||
| 4 |
|
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
|
|
|
|
| ||
| 5 |
|
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
|
|
|
|
| ||
| 6 |
|
|
* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
|
|
|
|
|
| ||
| 7 | Fr |
Ra |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Uut |
Fl |
Uup |
Lv |
Uus |
Uuo | ||
| * Lantanídios | La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu | |||||
| ** Actinídios | Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||||
Legenda da tabela
| Metais | Semimetais | Não metais | Desconhecidos | |||||||
| Metais alcalinos2 |
Metais alcalinoterrosos2 | Metal de transição | Metais de transição2 | Metais representativos | Não metais | Halogênios3 | Gases nobres3 | |||
| Lantanídios1, 2 | Actinídios1, 2 | |||||||||
| Cor do número atômico: Estado físico (CNTP): | preto: sólido | verde: líquido | vermelho: gás | cinza: desconhecido |
| Cor e estilo da borda indica incidência na natureza: | elemento primordial | decaimento | elemento sintético |
Ver também
[editar | editar código-fonte]Bibliografia
[editar | editar código-fonte]- Peter Vollhardt, Neil E. Schore, Química Orgânica - 6.ed.: Estrutura e Função , Bookman Editora, 2013 ISBN 8-565-83732-7
Referências
- ↑ Misselt, K.; Krause, O.; Birkmann, S.; Usuda, T.; Hattori, T.; Goto, M.; Rieke, G.; (Abril de 1916). «THE ATOM AND THE MOLECULE». J. Am. Chem. Soc. 38 (4): 762–785. doi:10.1021/ja02261a002
- ↑ LEWIS, Gilbert Newton. The Atom and the Molecule. American Chemical Society, 1916.[ligação inativa]
- ↑ Gilbert Newton Lewis, Chemistry: Berkeley
- ↑ estrutura de Lewis
- ↑ Estrutura de Lewis e Geometria de moléculas[ligação inativa]
- ↑ Lewis Diagrams for Multiple Bonds
- ↑ QUÍMICA APLICADA (em castelhano)
- ↑ Diagramas de Ponto de Lewis dos Elementos (em inglês)
Notas
- ↑ representa um elétron na camada de valência do elemento químico.
- ↑ Hidrogénio (português europeu) ou Hidrogênio (português brasileiro)
- ↑ Nitrogénio (português europeu) ou Nitrogênio (português brasileiro)
- ↑ Oxigénio (português europeu) ou Oxigênio (português brasileiro)
- ↑ Néon (português europeu) ou Neônio (português brasileiro)
- ↑ Argónio (português europeu) ou Argônio (português brasileiro)
- ↑ Arsénio (português europeu) ou Arsênio (português brasileiro)
- ↑ Selénio (português europeu) ou Selênio (português brasileiro)
- ↑ Crípton (português europeu) ou Criptônio (português brasileiro)
- ↑ Antimónio (português europeu) ou Antimônio (português brasileiro)
- ↑ Xénon (português europeu) ou Xenônio (português brasileiro)
- ↑ polónio (português europeu) ou Polônio (português brasileiro)
- ↑ Radónio (português europeu) ou Radônio (português brasileiro)
























































